【www.guakaob.com--教案】
《氧化还原反应》教案
【授课章节】人教版高中化学必修1第二章第三节
一,教学目标
【知识与技能】
初步掌握根据化合价的变化分析及判断氧化还原反应的方法。 【过程与方法】
学习由表及里以及逻辑推理的抽象思维方法。 【情感,态度,价值观】
从氧化还原这一对典型的矛盾,领悟对立统一的辩证唯物主义观点。
二, 教学内容
①复习初中学过的四大基本反应类型,氧化反应,还原反应以及它们的分类依据; ②从得失氧的角度定义:凡是有得失氧的反应是氧化还原反应(局限性);
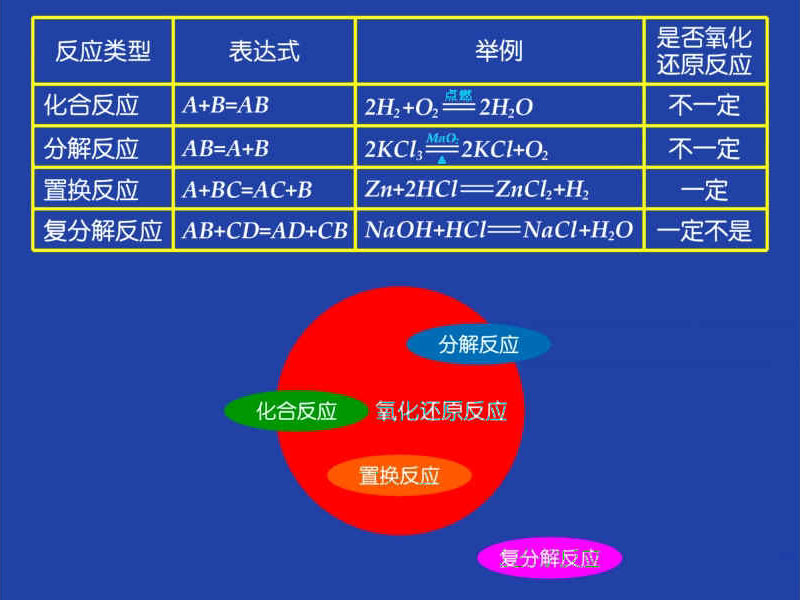
③从化合价的角度定义:凡有化合价升降的反应属于氧化还原反应(不一定有氧参与); ④用集合法归纳氧化还原反应与四大基本反应之间的关系。
三,教学重难点
重点: ①用化合价的观点分析氧化还原反应
②掌握氧化还原反应中的对立统一关系,形成一种基本的科学素养 难点:氧化还原的概念及特征 四,教学过程与方法
六,板书设计
氧化还原反应
氧化还原反应的概念
1,原始特征:凡有得失氧发生的化学反应属于氧化还原反应。(局限性) 2,表面现象:凡有化合价升降的化学反应都属于氧化还原反应。 (不一定存在得失氧,适用于一切化学反应)
氧化还原反应 第一课时
。。。。。。。。。。 陶流鸿
一 教学目标: 1、知识与技能:
(1)初步掌握根据化合价的变化和电子转移的观点分析氧化还原反应的方法。
(2)会用化合价的变化和电子转移的观点判断氧化还原反应,理解氧化还原反应的实质。
2、过程与方法:
(1)体验氧化还原反应从得氧失氧的原始特征到化合价升降的表面现象再到电子转移的本质原因层
层推进,逐步深入的发展过程。
(2)通过对氧化还原反应的特征和本质的分析,学习由表及里以及逻辑推理的抽象思维方法。 3、情感态度与价值观:
通过氧化和还原这一对典型矛盾,它们既相反又相互依存的关系的认识,深刻体会对立统一规律在自然现象中的体现,树立用正确的观点和方法学习化学知识。 二 教学重难点:
重点:用化合价升降和电子转移的观点理解氧化还原反应。 难点:理解氧化还原反应的本质。 三 教学策略:
教学方法:讨论法、讲授法、总结归纳法、练习反馈法等。
教学主线:
四 教学过程:
1
3
第三节 氧化还原反应
一、氧化还原反应的概念
1、表观认识:得氧失氧 (片面) 2、特征认识:化合价升降 (判断依据) 3、本质认识:电子转移 (本质)
4
第三节:氧化还原反应
教学目的3:
1. 巩固学习氧化还原反应的相关知识,强化训练。 教学课时:
2.5课时
知识体系 3
1.元素化合价在化学反应中的变化(B)
⑪ 氧化还原反应:凡有元素化合价升降的化学反应就是氧化还原反应。
氧化反应:在氧化还原反应中,反应物所含元素化合价升高的反应称为氧化反应; 还原反应:在氧化还原反应中,反应物所含元素化合价降低的反应称为还原反应。 非氧化还原反应:凡没有元素化合价升降的化学反应,就是非氧化还原反应。 ⑫ 氧化还原反应特征(判别方法):化合价发生变化。 2.氧化还原反应的实质 (B)
⑪ 元素化合价升降的实质:化合价升高,该元素原子在反应中失去电子;化合价降低,该元素原子在反应中得到电子。
⑫ 氧化还原反应的本质:反应过程中有电子得失(或偏移)。 3. 氧化剂和还原剂(C) ⑪ 定义:
① 从化合价角度定义:在氧化还原反应中,所含元素的化合价降低的反应物,称为氧化剂;在氧化还原反应中,所含元素的化合价升高的反应物,称为还原剂。
② 从电子转移角度定义:在氧化还原反应中,得到电子(或电子偏近)的反应物,称为氧化剂;在氧化还原反应中,失去电子(或电子偏离)的反应物,称为还原剂。 ⑫ 常见的氧化剂和还原剂

⑬ 价态与氧化剂、还原剂的关系:
① 元素为最低价态时,只具有还原性。I-,S2-等。
② 元素为最高价态时,只具有氧化性。Fe3+,H+,S+6等。
③ 元素处于中间价态时,既具有氧化性,又具有还原性。如S、SO2 ,Fe2+,I2,H2O2。
用心 爱心 专心【氧化还原反应教案】
- 1 -
⑭ 一般来说,氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。 ⑮ 酸性对氧化性的影响
影响氧化性的强弱。如:常温下,NO3—SO32—,在酸性下有氧化性,在中性或碱性下无氧化性,需要酸化才能表现出氧化性。又如:ClO—在酸性下比在碱性下氧化性更强。 ⑯ 温度影响氧化性。如:常温下,SO42—无氧化性,加热时可以表现出氧化性。
⑰ 最高价元素未必有氧化性。如:常温下,稀硫酸、碳酸、硅酸、磷酸及相对应的盐无氧化性。
⑱ 氧化剂的氧化性越强,其对应的还原产物还原性越弱。 ⑲ 氧化还原反应产物的价态有时与反应物的量有关。[

[基础达标3]
1. 下列各组物质露放在空气中,都有可能发生氧化还原反应而变质的一组是 A. 烧碱、消石灰 B. 纯碱、硫酸铜晶体 C. 过氧化钠、亚硫酸钠 D. 浓硫酸、浓硝酸
2. 从海水中可以提取溴,主要反应为:2Br— + Cl2 = 2Cl— + Br2,下列说法正确的是 A. 溴离子具有氧化性 B. 氯气是还原剂
C. 该反应属于复分解反应 D. 氯气的氧化性比溴单质强 3. 下列反应中,属于非氧化还原反应的是[
A.3Cl2+6NaOH =5NaCl+NaClO3+3H2O B.2Br—+Cl2=2Cl—+Br2 C. CaCO3+2HCl= CaCl2+H2O+CO2 D. CO2+Na2O2=Na2CO3+O2 4.下列叙述正确的是
A. 氧化还原反应的本质是化合价发生变化 B. 氧化剂在化学反应中得电子 C. 还原剂在反应中发生还原反应
D. 同一反应中反应物可能既发生氧化反应又发生还原反应 5. 下列变化过程中,属于还原反应的是
A.HCl→Cl2 B.Na→Na+ C.CO→CO2 D.Fe3+→Fe
6.下列物质在空气中久置变质,在变质过程中,既有氧化还原反应发生,又有非氧化还原反应发生的是
A. 食盐 B. 漂白粉 C. 氯水 D. 上述选项都不对
7.从矿物学资料查得,当胆矾溶液渗入地下,遇黄铁矿(FeS2)时可生成辉铜矿(Cu2S),同时还生成FeSO4和H2SO4,下列的有关叙述中正确的是
A.在反应中,FeS2是氧化剂不是还原剂
B.在反应中,CuSO4是氧化剂,FeS2是还原剂
+
C.反应中Cu2与FeS2的物质的量之比是14:5 D.反应中每生成1 mol Cu2S共得2 mol电子
用心 爱心 专心
- 2 -
8.下列物质:①浓H2SO4;②HNO3;③Cl2;④H2;⑤O2;⑥Ag;⑦HCl溶液;⑧KMnO4;⑨MnO2;⑩CO。其中属于常见的氧化剂的一组是 A.①②③④⑤⑧⑨ B.①②③⑤⑧⑨ C.①②③⑤⑦⑥⑧ D.①②③⑤⑦⑨⑩
9. 吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用Na2SeO3清除人体内的活性氧,则Na2SeO3的作用是 A. 还原剂 B. 氧化剂
C. 既是氧化剂又是还原剂 D. 以上均不是 10.H可以跟NH3反应,H+NH3===NH2+H2,根据该反应事实,可以得出的正确结论是
-
-
A.NH3具有还原性 B.H是很强的还原剂 C.H2是氧化产物,NH2是还原产物 D.该反应属于置换反应
11. 单质X和Y相互反应生成化合物X2+Y2-,有下列叙述: ①X被氧化 ②X是氧化剂 ③X具有氧化性 ④XY既是氧化产物也是还原产物 ⑤XY中的2-2+2+
Y具有还原性 ⑥XY中的X具有氧化性 ⑦Y的氧化性比XY中的X氧化性强。 以上叙述正确的是
A. ①④⑤⑥⑦ B. ①③④⑤ C. ②④⑤ D. ①②⑤⑥⑦
12.在反应:H2S + H2SO4(浓) == S + SO2 + 2 H2O 中,下列说法正确的是
A. S是还原产物,SO2 是氧化产物 B. S是氧化产物,SO2 是还原产物 C. 该反应的电子转移数目是6e- D. H2S是还原剂,被还原为S
13. 在3Cl2 + 6KOH = KClO3 + 5KCl + 3H2O 中,还原产物和氧化产物的物质的量之比为 A.1︰5 B.1︰3 C.5︰1 D.3︰1
+-++-+
14.根据反应式:①2Fe3+2I===2Fe2+I2;②Br2+2Fe2===2Br+2Fe3,可判断离子的还原性从强到弱的顺序是
-+--+-
A.Br、Fe2、I B.I、Fe2、Br
--++--
C.Br、I、Fe2 D.Fe2、I、Br
--
15.3个SO32恰好将2个XO4离子还原,则X元素在还原产物中的化合价是 A.+1 B.+2 C.+3 D.+4 16.下列叙述中正确的是【氧化还原反应教案】
A.含金属元素的离子不一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原 D.金属阳离子被还原一定得到金属单质
17.盐酸与氯气均可以和铁反应,从产物中比较可得出氯气比盐酸强的性质是 A.氧化性 B.还原性 C.酸性 D.金属性
18.下列各组物质间反应,其中水既不作氧化剂又不作还原剂的氧化还原反应是 ①Na和H2O ②Na2O2和H2O ③P2O5和H2O ④Cl2和H2O ⑤NO2和H2O A.③④⑤ B.①②④ C.②④⑤ D.①③⑤
19.制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为 2FeCl3 + Cu=2FeCl2 +CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是 A.烧杯中有铜无铁 B.烧杯中有铁无铜 C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
20.漂尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降,它与空气中的SO2和O2接触会使SO2部分转化为SO3,使空气的酸度增加。漂尘所起的作用是
用心 爱心 专心
- 3 -
-
A. 氧化剂 B. 还原剂 C. 催化剂 D. 干燥剂
课后有感
本节复习内容属于C.掌握要求的内容,必考的考点,与物质的量的计算相结合,需进行强化训练,难点是对电子转移分析和量的计算。
用心 爱心 专心 - 4 -
氧化还原反应(第一课时)教学设计
本节为高中化学必修一(鲁科技版)第二章第三节内容。
【教材依据】
【设计思路】
指导思想
新课程标准重在培养学生分析问题,解决问题的能力。基于这样的培养目的,教学设计中要体现出学生作为教学活动的主体,让学生积极的参与到教学实践中来。本节课堂教学模式是在课前预习的基础上,通过课堂创设情景,提出问题,学生讨论交流,进行活动探究,总结得出结论。其目的是让学生在教师的引导下通过自己的思考,分析,实验,得出结论。
设计理念
本节课通过分析参加反应的各物质所含元素化合价是否有变化,建立氧化还原反应的概念,然后探讨氧化还原的本质。
教材分析【氧化还原反应教案】
在中学阶段的化学基本概念,基础理论知识中,氧化还原反应占有非常重要的地位,是中学化学教学的重点和难点之一。中学涉及元素化合价变化的反应都是氧化还原反应。只有让学生掌握氧化还原反应的基本概念,才能使他们真正理解这些反应的实质,正确探究物质的氧化性和还原性。
在初中化学学习中,学生已经接触了许多化学反应,并能根据四种基本反应类型对化学反应进行分类,但是,没有从得氧失氧角度认识化学反应,更没有形成氧化还原反应概念。由于得氧失氧并不是氧化还原反应的实质,本节课引导学生直接从化合价的层面认识氧化还原反应。
学情分析
学生通过初中的学习已经认识化学中常用的元素的化合价,有能力分析清楚物质中各种元素的化合价,也初步了解了电子转移对元素化合价的影响。为课堂上讨论氧化还原反应的本质奠定了知识基础。学生来自各个初中,讨论问题能力参差不齐,但是经过这一个多月的前期培养,分析,讨论的能力有提高。
【教学目标】
知识与技能
①学会用化合价的变化和电子转移的观点判断氧化还原反应;初步掌握根据化合价的变化和电子转移的观点分析氧化还原反应的方法;理解氧化还原反应的本质就是发生了电子转移。
②掌握四种基本反应类型与氧化还原反应之间的关系。 过程与方法:
掌握探究物质氧化性和还原性的过程与方法。 情感态度与价值观:
①使学生体会到氧化还原反应的普遍存在,并能举例说明生产生活中的氧化还原反应。②进行“透过现象看本质”和“对立统一”的辨证唯物主义观点教育。
【教学重点】
用化合价升降和电子转移的观点理解氧化还原反应
【教学难点】
用化合价升降和电子转移的观点分析氧化还原反应;让学生掌握氧化还原反应的概念
及其中的对立统一的关系。
【教学准备】
学生准备 复习初中化学中常用的元素的化合价,预习氧化剂还原剂知识。 教师准备 教学媒体、课件;锌-石墨-硫酸铜原电池装置。
氧化还原反应 教学方案(设计)
教学过程
上一篇:华东师大版八年级上册数学
下一篇:北师大版高一英语教案